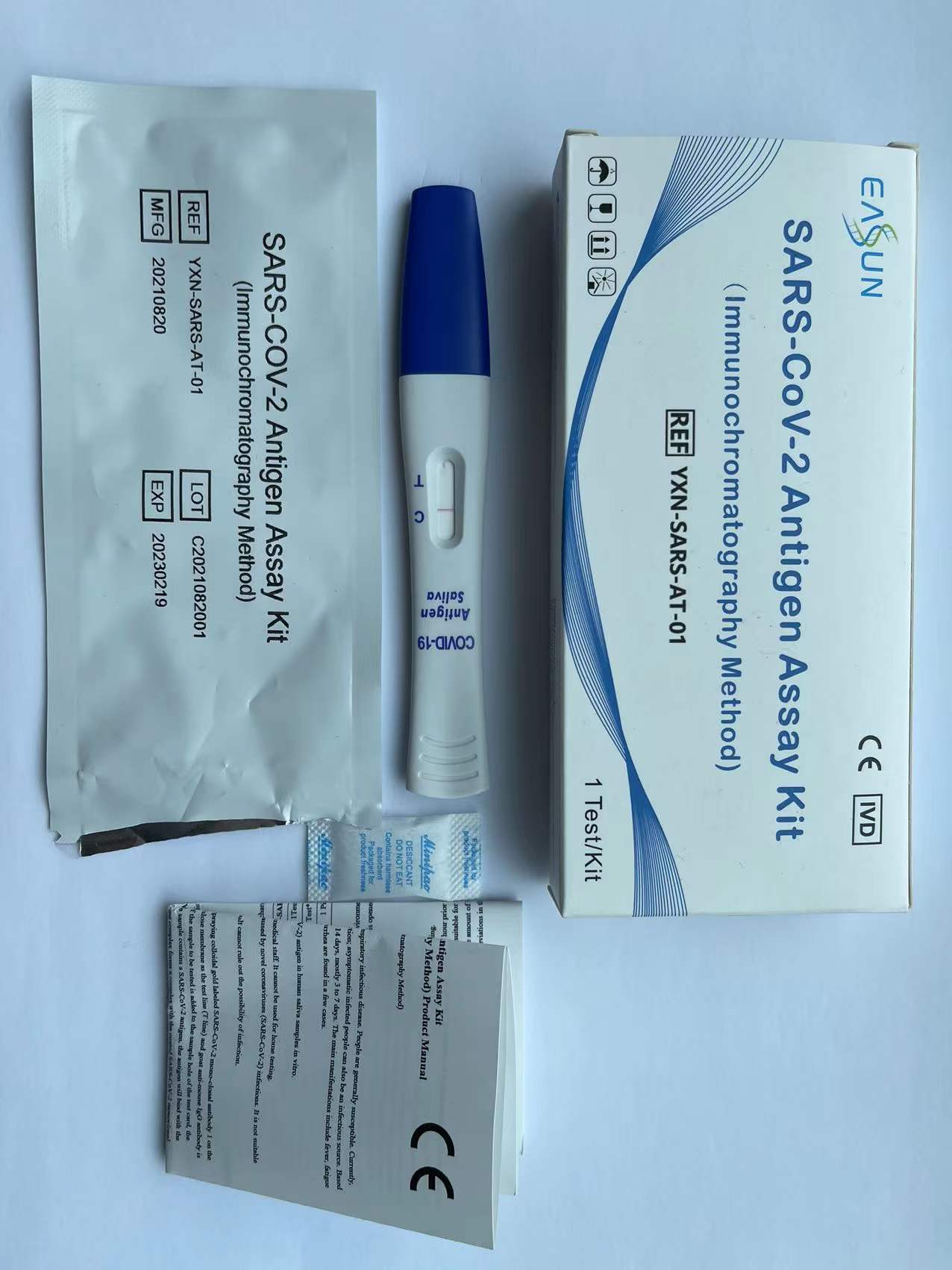
Kit de ensayo de antígeno SARS-CoV-2 (método de inmunocromatografía)
SARS-CoV-2 Antigen Assay Kit
(Immunochromatography Method) Product Manual
【PRODUCT NAME】Kit de ensayo de antígeno SARS-CoV-2(Método de inmunocromatografía)
【PackagING SPECIFIGATOIONS】1 prueba/kit
【ABSTRACTO】
Los nuevos coronavirus pertenecen al género β. COVID-19 es una enfermedad infecciosa respiratoria aguda. Las personas son generalmente susceptibles. Actualmente, los pacientes infectados por el nuevo coronavirus son la principal fuente de infección; Las personas infectadas asintomáticas también pueden ser una fuente de infección. Según la investigación epidemiológica actual, el período de incubación es de 1 a 14 días, principalmente de 3 a 7 días. Las principales manifestaciones incluyen fiebre, fatiga y tos seca. En algunos casos se encuentran congestión nasal, secreción nasal, dolor de garganta, mialgia y diarrea.
【EXPECTED USAGE】
Este kit se utiliza para detectar cualitativamente el antígeno del nuevo coronavirus (SARS-CoV-2) en muestras de saliva humana in vitro. Sólo es apto para diagnóstico profesional in vitro, no para uso personal.
Este producto sólo se utiliza en laboratorios clínicos o en pruebas inmediatas realizadas por personal médico. No se puede utilizar para pruebas caseras.
No puede utilizarse como base para el diagnóstico y la exclusión de la neumonía causada por infecciones por nuevos coronavirus (SARS-CoV-2). No es adecuado para el cribado en la población general.
Un resultado positivo de la prueba requiere confirmación adicional y un resultado negativo no puede descartar la posibilidad de infección.
【PRINCIpor favorS OF THE PRepública de ChinaEDURE】
Este producto adopta tecnología de inmunocromatografía de oro coloidal, rociando el anticuerpo monoclonal 1 SARS-CoV-2 marcado con oro coloidal en la almohadilla dorada. El anticuerpo monoclonal 2 SARS-CoV-2 está recubierto sobre una membrana de nitrocelulosa como la línea de prueba (línea T) y la cabra. El anticuerpo anti-IgG de ratón está recubierto como línea de control de calidad (línea C). Cuando se agrega una cantidad adecuada de la muestra a analizar al orificio de muestra de la tarjeta de prueba, la muestra avanzará a lo largo de la tarjeta de prueba bajo acción capilar. Si la muestra contiene un antígeno del SARS-CoV-2, el antígeno se unirá al anticuerpo monoclonal 1 del SARS-CoV-2 marcado con oro coloidal y el complejo inmunitario forma un complejo con el anticuerpo monoclonal 2 del SARS-CoV-2 recubierto en el extremo. Línea T, que muestra una línea T de color rojo púrpura, que indica que el antígeno SARS-CoV-2 es positivo. Si la línea de prueba T no muestra color y muestra un resultado negativo, significa que la muestra no contiene el antígeno SARS-CoV-2. La tarjeta de prueba también contiene una línea de control de calidad C; independientemente de si hay una línea de prueba, debería aparecer la línea de control de calidad C de color rojo púrpura. Si la línea de control de calidad C no aparece, indica que el resultado de la prueba no es válido y esta muestra debe analizarse nuevamente.
【MAIN COMPONENTS】
(1) Tarjeta de prueba.
(2) Manual.
Nota: Los componentes de diferentes lotes de kits no se pueden usar indistintamente.
| Cat. No. | YXN-SARS-AT-01 |
| Package Specifications | 1Prueba/Kit |
| casete de prueba | 1 prueba* 1 paquete |
| Manual | 1 pieza |
【STORAGE AND EXPIRATION】
El período de validez es de 18 meses si este producto se almacena en un ambiente de 2 ℃ -30 ℃.
El producto debe usarse dentro de los 15 minutos una vez abierta la bolsa de aluminio. Cubra la tapa inmediatamente después de sacar la solución de extracción de muestra. La fecha de producción y la fecha de caducidad están indicadas en la etiqueta.
【SAMPLE REQUIREMotorrinolaringólogoS】
1. Aplicable a hisopos de garganta nasal humana, hisopos de garganta oral y muestras de saliva.
2. Recogida de muestras:
(1) Recolección de saliva (YXN-SARS-AT-01): Realice la higiene de manos con agua y jabón o un desinfectante para manos a base de alcohol. Abre el contenedor. Haga un ruido de Kruuua' con la garganta para limpiar la saliva de la garganta profunda y luego escupa saliva (aproximadamente 2 ml) en el recipiente. Evite cualquier contaminación con saliva de la superficie exterior del recipiente. Momento óptimo para la recolección de muestras: después de levantarse y antes de cepillarse los dientes, comer o beber.
3. Procese la muestra inmediatamente con la solución de extracción de muestras proporcionada en el kit después de recolectar la muestra. Si no se puede procesar inmediatamente, la muestra debe almacenarse en un tubo de plástico seco, esterilizado y estrictamente sellado. Se puede almacenar a 2 ℃ -8 ℃ durante 8 horas y se puede almacenar durante mucho tiempo a -70 ℃.
4. Las muestras que estén muy contaminadas con residuos de alimentos orales no se pueden utilizar para analizar este producto. No se recomiendan muestras recolectadas de hisopos que sean demasiado viscosos o aglomerados para analizar este producto. Si los hisopos están contaminados con una gran cantidad de sangre, no se recomienda realizar pruebas. No se recomienda utilizar muestras procesadas con una solución de extracción de muestras que no se proporciona en este kit para probar este producto.
【TESTING METHOD】
Lea atentamente el manual de instrucciones antes de realizar la prueba. Devuelva todos los reactivos a temperatura ambiente antes de la prueba. La prueba debe realizarse a temperatura ambiente.
Pasos de prueba:
1.Muestra de saliva (YXN-SARS-AT-01):
(1) Después de que el casete de prueba vuelva a la temperatura ambiente, abra la bolsa de papel de aluminio, saque el casete de prueba y colóquelo horizontalmente sobre el escritorio.
(2) Retire la punta del casete de prueba, sumerja la varilla del casete de prueba en saliva o coloque la varilla del casete de prueba debajo de la lengua durante 2 minutos.
(3) Mantenga el casete de prueba en posición vertical y deje que el líquido de la saliva se mueva hacia arriba hasta que alcance o pase por encima de la Línea C, luego vuelva a colocar la tapa y coloque el casete de prueba sobre el escritorio.
(4) Lea los resultados mostrados dentro de 15 a 30 minutos y los resultados leídos después de 30 minutos no son válidos.
【[INTERPREHACER ENCAJEION OF TEST RESULTS】
| ★Tanto la línea de prueba (T) como la línea de control (C) muestran bandas de color como se muestra en la imagen a la derecha, lo que indica que el antígeno SARS-CoV-2 es positivo. | |
| ★NEGATIVO: Si solo la línea de control de calidad C desarrolla color y la línea de prueba (T) no desarrolla color, no se detecta el antígeno SARSCoV-2 y el resultado es negativo, como se muestra en la imagen de la derecha. | |
| ★NO VÁLIDO: No aparece ninguna banda de color en la línea de control de calidad (C) y se considera un resultado no válido independientemente de si la línea de detección (T) muestra una banda de color o no, como se muestra en la imagen a la derecha. La línea de control no Aparece un volumen de muestra insuficiente o técnicas de procedimiento incorrectas son las razones más probables de la falla de la línea de control. Revise el procedimiento y repita la prueba con un nuevo casete de prueba. Si el problema persiste, deje de usar el kit de prueba inmediatamente y comuníquese con su distribuidor local. |
【LIMITATION OF DETECTARION MÉTODO】
1. Verificación clínica
Para evaluar el rendimiento del diagnóstico, este estudio utilizó muestras positivas para COVID-19 de 150 personas y muestras negativas para COVID-19 de 350 personas. Estas muestras fueron analizadas y confirmadas mediante el método RT-PCR. Los resultados son los siguientes:
a) Sensibilidad: 92,67% (139/ 150), IC95% (87,26%, 96,28%).
b) Especificidad: 98,29% (344/350), IC95% (96,31%, 99,37%).
2. Límite mínimo de detección:
Cuando el contenido de virus es superior a 400 TCID50/ml, la tasa de detección positiva es superior al 95 %. Cuando el contenido de virus es inferior a 200 TCID50/ml, la tasa de detección positiva es inferior al 95 %, por lo que el límite mínimo de detección de este producto es 400 TCID50/ml.
3. Precisión:
Se probó la precisión de tres lotes consecutivos de reactivos. Se utilizaron diferentes lotes de reactivos para analizar la misma muestra negativa 10 veces seguidas y todos los resultados fueron negativos. Se utilizaron diferentes lotes de reactivos para analizar la misma muestra positiva 10 veces seguidas, y el
Los resultados fueron todos positivos.
4. Efecto GANCHO:
Cuando el contenido de virus en la muestra a analizar alcanza 4,0*105TCID50/ml, el resultado de la prueba aún no muestra el efecto GANCHO. 5. Reactividad cruzada
Se evaluó la reactividad cruzada del kit. Los resultados no mostraron reactividad cruzada con la siguiente muestra.
| No | Artículo | concentrado | No | Artículo | concentrado |
| 1 | VHC-HKU1 | 105TCID50/ml | 16 | Gripe A H3N2 | 105TCID50/ml |
| 2 | Estafilococo aureus | 106TCID50/ml | 17 | H7N9 | 105TCID50/ml |
| 3 | Estreptococos del grupo A | 106TCID50/ml | 18 | H5N1 | 105TCID50/ml |
| 4 | Virus del sarampión | 105TCID50/ml | 19 | Virus de Epstein-Barr | 105TCID50/ml |
| 5 | Virus de las paperas | 105TCID50/ml | 20 | Enterovirus CA16 | 105TCID50/ml |
| 6 | Adenovirus tipo 3 | 105TCID50/ml | 21 | Rinovirus | 105TCID50/ml |
| 7 | Neumonía por micoplasma | 106TCID50/ml | 22 | Virus sincitial respiratorio | 105TCID50/ml |
| 8 | Paraimfluenzavirus, tipo 2 | 105TCID50/ml | 23 | Estreptococo neumonía | 106TCID50/ml |
| 9 | metaneumovirus humano | 105TCID50/ml | 24 | Candida albicans | 106TCID50/ml |
| 10 | Coronavirus humano OC43 | 105TCID50/ml | 25 | clamidia neumonía | 106TCID50/ml |
| 11 | coronavirus humano 229E | 105TCID50/ml | 26 | Bordetella pertussis | 106TCID50/ml |
| 12 | Bordetella parapertusis | 106TCID50/ml | 27 | Pneumocystis jiroveci | 106TCID50/ml |
| 13 | Cepa de influenza B Victoria | 105TCID50/ml | 28 | Mycobacterium tuberculosis | 106TCID50/ml |
| 14 | Cepa de influenza B Y | 105TCID50/ml | 29 | Legionella pneumophila | 106TCID50/ml |
| 15 | Gripe A H1N1 2009 | 105TCID50/ml |
6. Sustancias de interferencia
Los resultados de la prueba no interfieren con la sustancia en la siguiente concentración:
| No | Artículo | concentrado | No | Artículo | concentrado |
| 1 | sangre entera | 4% | 9 | mucina | 0 50% |
| 2 | Ibuprofeno | 1mg/ml | 10 | Gel compuesto de benjuí | 1,5 mg/ml |
| 3 | tetraciclina | 3ug/ml | 11 | glicato de cromolín | 15% |
| 4 | cloranfenicol | 3ug/ml | 12 | Clorhidrato de desoxiepinefrina | 15% |
| 5 | Eritromicina | 3ug/ml | 13 | Afrin | 15% |
| 6 | tobramicina | 5% | 14 | Aerosol de propionato de fluticasona | 15% |
| 7 | oseltamivir | 5mg/ml | 15 | mentol | 15% |
| 8 | Gotas nasales de hidrocloruro de nafazolina | 15% | 16 | mupirocina | 10mg/ml |
【LIMIHACER ENCAJEION OF DETECTARION METHOD】
1. Este producto solo se proporciona a laboratorios clínicos o personal médico para pruebas inmediatas y no se puede utilizar para pruebas caseras.
2. Este producto sólo es adecuado para la detección de muestras de secreción de garganta o cavidad nasal humana. Detecta el contenido del virus en el extracto de muestra, independientemente de si el virus es infeccioso. Por lo tanto, es posible que los resultados de las pruebas de este producto y los resultados del cultivo de virus de la misma muestra no estén correlacionados.
3. La tarjeta de prueba y la solución de extracción de muestras de este producto deben restaurarse a temperatura ambiente antes de su uso. Una temperatura inadecuada puede provocar resultados anormales en la prueba.
4. Durante el proceso de prueba, es posible que los resultados de la prueba no coincidan con los resultados clínicos debido a una recolección insuficiente de muestras de hisopos estériles o una operación incorrecta de recolección y extracción de muestras.
5. Durante el uso de este producto, debe seguir estrictamente los pasos operativos del manual. Los pasos operativos y las condiciones ambientales inadecuados pueden provocar resultados anormales en las pruebas.
6. El hisopo se debe girar unas 10 veces en la pared interna del tubo de ensayo que contiene la solución de extracción de muestra. Muy pocas o demasiadas rotaciones pueden provocar resultados anormales en las pruebas.
7. Un resultado positivo de este producto no puede descartar la posibilidad de que otros patógenos sean positivos.
8. Un resultado negativo de la prueba de este producto no puede descartar la posibilidad de que otros patógenos sean positivos.
9. Se recomienda verificar los resultados negativos de la prueba con reactivos de detección de ácido nucleico para evitar el riesgo de omitir la prueba.
10. Puede haber diferencias en los resultados de las pruebas entre muestras clínicas congeladas y muestras clínicas recién recolectadas.
11. La muestra debe analizarse inmediatamente después de su recolección para evitar resultados anormales después de dejarla demasiado tiempo.
12. Durante el uso de este producto, es necesaria una cantidad de muestra adecuada; una cantidad de muestra demasiado pequeña o excesiva puede causar resultados anormales en la prueba. Se recomienda utilizar una pipeta con un volumen de muestra más preciso para la prueba de adición de muestras.
【PREcautIONS】
1. Equilibre el diluyente de muestra y la tarjeta de prueba a temperatura ambiente (más de 30 minutos) antes de realizar la prueba.
2. La inspección deberá realizarse estrictamente de acuerdo con las instrucciones.
3. El resultado debe interpretarse dentro de 15 a 30 minutos y el resultado leído después de 30 minutos no es válido.
4. La muestra de prueba debe considerarse una sustancia infecciosa y la operación debe realizarse de acuerdo con las especificaciones operativas del laboratorio de enfermedades infecciosas, con medidas de protección y atención a la operación de bioseguridad.
5. Este producto contiene sustancias de origen animal. Aunque no es contagioso, se debe tratar con precaución al manipular posibles fuentes de infección. Los usuarios deben tomar medidas de protección para garantizar su seguridad y la de los demás.
6. Las tarjetas de prueba usadas, extractos de muestras, etc. se tratan como desechos biomédicos después de la prueba y se lavan las manos a tiempo.
7. Si la solución de tratamiento de muestras de este producto se derrama accidentalmente sobre la piel o los ojos, enjuáguelos inmediatamente con abundante agua y busque atención médica si es necesario.
8. No utilice el kit con daños evidentes ni la tarjeta de prueba con el paquete dañado.
9. Este producto es un producto de un solo uso, no lo reutilice ni utilice productos caducados.
10. Evite la luz solar directa y el soplado directo de ventiladores eléctricos durante las pruebas.
11. No se pueden utilizar agua del grifo, agua destilada o agua desionizada ni bebidas como reactivos de control negativo.
12. Debido a la diferencia de las muestras, algunas líneas de prueba pueden ser de color más claro o grisáceo. Como producto de calidad, siempre que haya una banda en la posición de la línea T, se puede considerar positivo.
13. Si la prueba es positiva, se recomienda utilizar esta tarjeta de prueba para volver a verificarla una vez y evitar pequeños eventos de probabilidad.
14. Hay un desecante en la bolsa de papel de aluminio, no lo tomes por vía oral.